Lunes, 20 de Abril del 2020
El propósito de hoy es explicar que las formaciones de los diferentes compuestos del carbono dependen de la capacidad de enlace de los átomos de carbono.
UNIDOS FUERTEMENTE POR ENLACES COVALENTES
Observa el siguiente vídeo
Después de la observación del vídeo haciendo uso de tus conocimientos previos responde las siguientes preguntas que se encuentran en la classroom.
- ¿Qué características comunes observan en animales híbridos? ¿Puedes describir un ejemplo de lo observado?
- ¿Por qué creen que posee dichas características?¿Por qué son híbridos?
- ¿En qué otras situaciones han oído hablar de hibridación?
- ¿Crees que esto pueda suceder con materiales no vivientes como en el caso del carbono?
- ¿Por qué el carbono puede tener miles de compuestos?¿Ocurrirá lago similar que con los híbridos en animales y plantas?
QUÍMICA ORGÁNICA
También llamada Química del carbono como comúnmente se conoce, es la rama de la química que estudia una clase numerosa de sustancias que contienen carbono en las que además se pueden encontrar el hidrógeno, el nitrógeno y otros elementos del sistema periódico. Forman enlaces covalentes carbono-carbono o carbono-hidrógeno, también conocidos como compuestos orgánicos.
Friedrich Wöhler y Archibald Scott Couper son conocidos como los "padres" de la química orgánica.
La gran cantidad de compuestos orgánicos que existen tiene su explicación en las características del átomo de carbono, que tiene cuatro electrones en su última capa de valencia: según la regla del octeto necesita ocho para completarla, por lo que forma cuatro enlaces (valencia = 4) con otros átomos formando un tetraedro, una pirámide de base triangular.
Existen millones de
compuestos orgánicos frente a aproximadamente unos 300.000 de los compuestos
inorgánicos debido a lo que a continuación explicaremos.
Luego realiza la lectura sobre las Propiedades de los Compuestos Orgánicos y elabora un organizador visual en base a tus anotaciones que se encuentra en la classroom.
HIBRIDACIÓN DEL ÁTOMO DE CARBONO
La hibridación del carbono implica la combinación de dos orbitales atómicos puros para formar un nuevo orbital "híbrido" con características propias.
El átomo de carbono en su estado fundamental posee seis electrones, cuya configuración es 1s22s22p2 . Es decir, deberían ocupar el nivel 1s (dos electrones), el 2s (dos electrones y parcialmente el 2p (los dos electrones restantes).
Esto quiere decir que el átomo de carbono solo posee dos electrones desapareados en el orbital 2p, pero así no es posible explicar la formación ni geometría de las moléculas orgánicas.
Así que para formar estos enlace se necesita la hibridación de los orbitales s y p para generar nuevos orbitales híbrido que expliquen incluso los enlaces dobles y triples donde los electrones adquieren la configuración más estable para la formación de las moléculas.
Tipos principales
A continuación se les presenta el vídeo sobre la naturaleza de la hibridación del átomo de carbono:
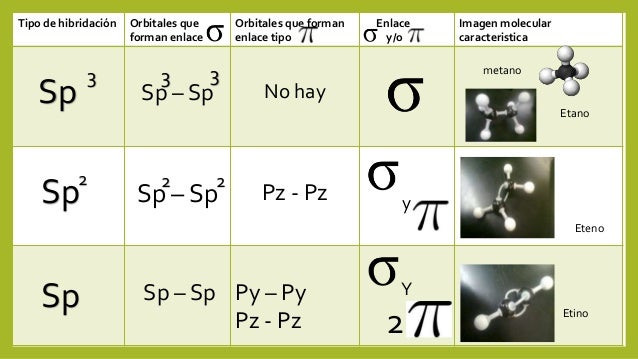
Hibridación sp3
Es la mezcla de un orbital s con tres
orbitales p (px, py y pz) para formar cuatro orbitales híbridos sp3 con
un electrón cada uno.

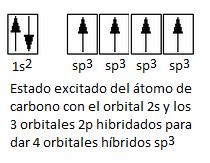
Los orbitales híbridos sp3 forman
un tetraedro (tridimensional) con ángulo de 109,5°. Este tipo
de hibridación es característica de los alcanos.

Luego observa el siguiente vídeo:
Hibridación sp2
Es la mezcla de un orbital s con dos
orbitales p (px y py) para formar tres orbitales híbridos sp2.

En la hibridación sp2 interaccionan un orbital s puro
con 2 orbitales p puros para formar tres orbitales híbridos atómicos con un
electrón cada uno con un ángulo máximo de repulsión de 120° aproximadamente y
permanece un orbital atómico p puro sin hibridar con un electrón. Este tipo de
hibridación es característica de los alquenos.

Hibridación sp
Es la mezcla de un orbital atómico s con un orbital p puro (px) para formar dos orbitales híbridos sp con un electrón cada uno y una máxima repulsión entre ellos de 180° y permanecen dos orbitales p puros con un electrón cada uno sin hibrida
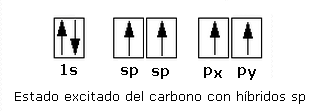
Los orbitales híbridos sp forman una figura
lineal (unidimensional).
La hibridación sp se presenta en los
átomos de carbono con triple enlace carbono-carbono en la familia de los
alquinos.

Para retroalimentar lo que hemos aprendido sobre la hibridación del átomo de carbono te invito a que observes el siguiente vídeo y tomes de nota de la información aquí proporcionada.
Observa el siguiente vídeo
- ¿Qué características comunes observan en animales híbridos? ¿Puedes describir un ejemplo de lo observado?
- ¿Por qué creen que posee dichas características?¿Por qué son híbridos?
- ¿En qué otras situaciones han oído hablar de hibridación?
- ¿Crees que esto pueda suceder con materiales no vivientes como en el caso del carbono?
- ¿Por qué el carbono puede tener miles de compuestos?¿Ocurrirá lago similar que con los híbridos en animales y plantas?
QUÍMICA ORGÁNICA
También llamada Química del carbono como comúnmente se conoce, es la rama de la química que estudia una clase numerosa de sustancias que contienen carbono en las que además se pueden encontrar el hidrógeno, el nitrógeno y otros elementos del sistema periódico. Forman enlaces covalentes carbono-carbono o carbono-hidrógeno, también conocidos como compuestos orgánicos.
Friedrich Wöhler y Archibald Scott Couper son conocidos como los "padres" de la química orgánica.
La gran cantidad de compuestos orgánicos que existen tiene su explicación en las características del átomo de carbono, que tiene cuatro electrones en su última capa de valencia: según la regla del octeto necesita ocho para completarla, por lo que forma cuatro enlaces (valencia = 4) con otros átomos formando un tetraedro, una pirámide de base triangular.
Existen millones de
compuestos orgánicos frente a aproximadamente unos 300.000 de los compuestos
inorgánicos debido a lo que a continuación explicaremos.
Luego realiza la lectura sobre las Propiedades de los Compuestos Orgánicos y elabora un organizador visual en base a tus anotaciones que se encuentra en la classroom.
HIBRIDACIÓN DEL ÁTOMO DE CARBONO
La hibridación del carbono implica la combinación de dos orbitales atómicos puros para formar un nuevo orbital "híbrido" con características propias.
El átomo de carbono en su estado fundamental posee seis electrones, cuya configuración es 1s22s22p2 . Es decir, deberían ocupar el nivel 1s (dos electrones), el 2s (dos electrones y parcialmente el 2p (los dos electrones restantes).
Esto quiere decir que el átomo de carbono solo posee dos electrones desapareados en el orbital 2p, pero así no es posible explicar la formación ni geometría de las moléculas orgánicas.
Así que para formar estos enlace se necesita la hibridación de los orbitales s y p para generar nuevos orbitales híbrido que expliquen incluso los enlaces dobles y triples donde los electrones adquieren la configuración más estable para la formación de las moléculas.
Tipos principales
A continuación se les presenta el vídeo sobre la naturaleza de la hibridación del átomo de carbono:
Es la mezcla de un orbital s con tres orbitales p (px, py y pz) para formar cuatro orbitales híbridos sp3 con un electrón cada uno.


Los orbitales híbridos sp3 forman
un tetraedro (tridimensional) con ángulo de 109,5°. Este tipo
de hibridación es característica de los alcanos.

Luego observa el siguiente vídeo:
Hibridación sp2
Hibridación sp2
Es la mezcla de un orbital s con dos orbitales p (px y py) para formar tres orbitales híbridos sp2.
En la hibridación sp2 interaccionan un orbital s puro
con 2 orbitales p puros para formar tres orbitales híbridos atómicos con un
electrón cada uno con un ángulo máximo de repulsión de 120° aproximadamente y
permanece un orbital atómico p puro sin hibridar con un electrón. Este tipo de
hibridación es característica de los alquenos.
Los orbitales híbridos sp2 forman
un triángulo equilátero (bidimensional).
La hibridación sp2 la presentan los dos átomos de carbono con
dobles enlaces carbono-carbono en la familia de los alquenos.

Hibridación sp
Es la mezcla de un orbital atómico s con un orbital p puro (px) para formar dos orbitales híbridos sp con un electrón cada uno y una máxima repulsión entre ellos de 180° y permanecen dos orbitales p puros con un electrón cada uno sin hibrida

Los orbitales híbridos sp forman una figura
lineal (unidimensional).
La hibridación sp se presenta en los
átomos de carbono con triple enlace carbono-carbono en la familia de los
alquinos.

Para retroalimentar lo que hemos aprendido sobre la hibridación del átomo de carbono te invito a que observes el siguiente vídeo y tomes de nota de la información aquí proporcionada.
Finalmente resuelve la ficha de aplicación 3 sobre el la Hibridación del átomo de carbono.

No hay comentarios:
Publicar un comentario